不锈钢的极化曲线,见图1-5。图1-5描述了不锈钢以及有活化、钝化转变的合金电极动力学过程,并按电位分为活化区(A)、钝化区(P)和过钝化区(T)。应用阳极极化曲线((E阳))及相关的阴极极化曲线(图1-5中的①、②、③、④)可以求得腐蚀电位和腐蚀电流密度(图1-5中的阳极极化曲线和阴极极化曲线的交点A、B、C、D、E、F)。
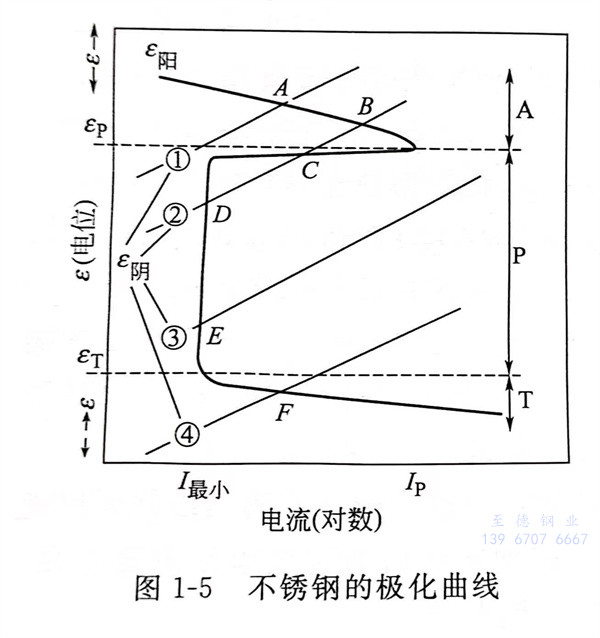
金属或合金在不同条件下,其电化学腐蚀有四种状态:一是活化状态,腐蚀电流强度较大,因而腐蚀速度较快;二是相对稳定状态,即金属处于可以钝化也可以活化状态;三是钝化稳定状态,金属只处于钝化状态,而且是稳定的,能够自动钝化,只有很小的腐蚀电流,腐蚀速度很小;四是过钝化状态,当金属处于过钝化状态时有较高的腐蚀电流,不锈钢也是如此。
为了提高不锈钢的耐腐蚀性能,一般希望:不锈钢易处于钝化状态,也就是可以自动钝化;不锈钢钝化后腐蚀电流密度要很低;不锈钢钝化状态的(腐蚀)电位范围要宽。
上述三点分别指出了不锈钢获得钝化的必要条件、钝化状态的腐蚀速度和钝化状态的相对稳定性。
不锈钢只有处在钝化状态方能耐腐蚀,这时钝化状态腐蚀电流最小,腐蚀速度最慢,其他三种状态下不锈钢都是不耐腐蚀的。由此可见,不锈钢的“不锈”是相对的,只是在钝化状态下,腐蚀速度比较慢。
保持不锈钢耐腐蚀性的重要物质是钝化薄膜。不锈钢的表面本来就会形成这种毫微级的钝化薄膜。现已明确,这种毫微级的钝化薄膜是以在铬的氧化物(Cr2O3)和氢氧根离子(OH-)结合后,进而加入水(H2O)的水合氢氧化铬化合物为主体的物质。
在中性的水溶液或硝酸中,不锈钢的钝化薄膜非常稳定。即使是由于划伤或破损等原因,使一部分薄膜被破坏了,它还具有立即再生和恢复的功能。前面谈到的环境氧化作用是指从金属原子中释放电子的反应,如果人为地借助于外部电源,将“试验金属”置于“试验溶液”中作为电解阳极并通电流,此时就能求出电位(氧化力)与电流(腐蚀速度)的相关曲线和环境的氧化力强度。这个曲线称为阳极分极曲线,如图1-5所示。
由图1-5可以看出,随着电位的升高,先是阳极氧化反应(溶解反应)呈增强趋势;接下来是“活化状态”电位区的电流增加;然后是不依赖于电位增加显示小电流的“钝化状态”电位区;最后再次出现随着电位的增加的“过钝化状态”电位区。这里的腐蚀电位Ecorr是成为阳极电流和阴极电流相等条件的电位。
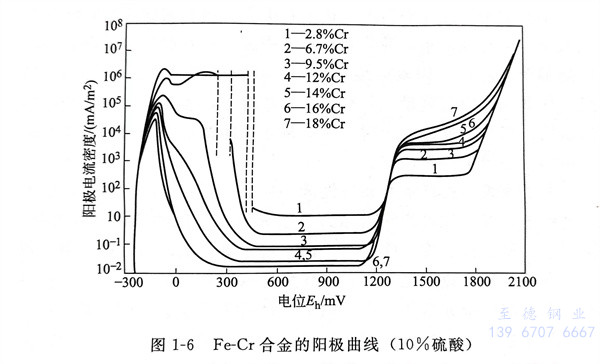
增加钢的铬含量,则阳极分极曲线的变化如图1-6所示。因铬的含量增加,最大阳极溶解电流及静态区的阳极电流趋向于减少。不锈钢的铬(Cr)含量在12%以上时,不锈钢易于从活性状态向钝化状态转移而呈现稳定的钝化状态。