氯化物-硫酸盐型混合体系镀Cr-Ni-Fe 不锈钢合金镀液组成及工作条件见表11-3 。
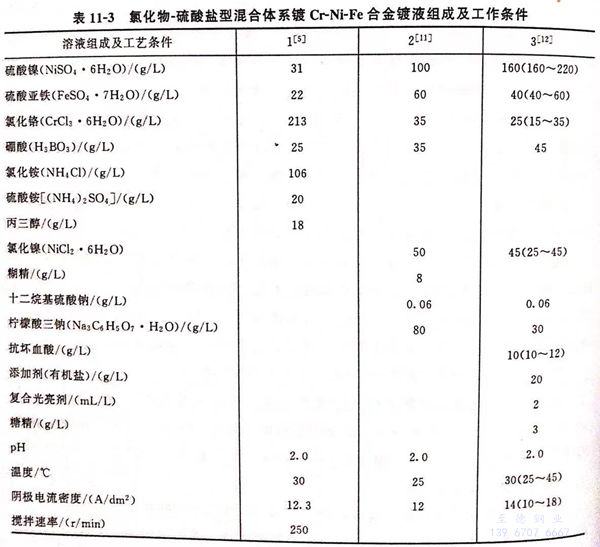
1. 配方1 (表11-3)
镀液中使的丙三醇(即甘油)是一种光亮剂,可提高镀层的光泽。
pH控制在1.8~2.2之间,pH较低时,镀液覆盖能力较差,沉积速率较快。
pH较高时,镀液覆盖能力较佳,但镀层色泽较暗,沉积速率较慢。用盐酸降低pH,用氨水提高pH.由于镀液中有硼酸缓冲剂的存在,使镀液的pH变化非常缓慢,一般在8~12h后用pH计测量,方可稳定准确测得镀液的pH,一旦加入过多的氨水,当pH>3.0时,三价铬会出现Cr(OH)。沉淀,造成镀液浑浊,要用盐酸加入降低pH至2,才能逐步缓慢溶解所生成的Cr(OH);沉淀。
本溶液要用电磁转动子搅拌电镀,电磁子转速为250r/min.
2. 配方2 (表11-3)
本配方中使用柠檬酸三钠作为配位剂,糊精作为提高镀层光泽的添加剂。
沉积速率实验结果见表11-4。
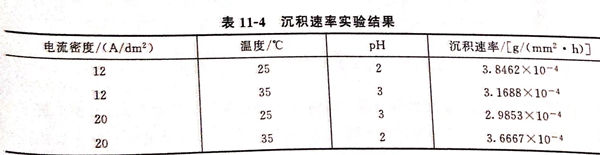
从表11-4可见,pH=2时,沉积速率最大,其次是电流密度,温度对沉积速率的影响最小。
镀层的电化学腐蚀测试:动电位扫描测试是将电极放在3.5%NaCl室温溶液中的,极化范围调到相对开路电位±0.2V,扫描速率0.2mV/s,测定阴阳极极化曲线,计算腐蚀速率,腐蚀电流的实验结果见表11-5。
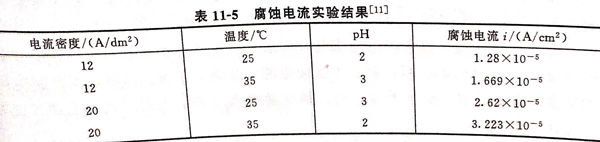
由表11-4、表11-5可见,不同工艺参数下,电镀得到的镀层的耐蚀性能相差很大,Fe-Cr-Ni合金在3.5%NaCl溶液中没有明显的钝化现象,但却显示了一定的延缓腐蚀效果,通过实验得出的最优方案为电流密度为12A/d㎡,温度为25℃,pH为2。
3. 配方3 (表11-3)
a. 镀液pH的影响
①. 镀液pH对镀层成分含量的影响
镀液pH对镀层成分含量的影响见图11-3(温度30℃,电流密度14A/dm2,CrCl3·6H2O 25g/L,Fe2+/NP+浓度比为1:5)。
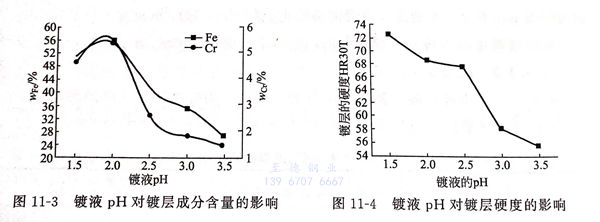
由图11-3可见,随着pH的升高,镀层中铁和铬的含量先略有升高,然后降低。pH=2时出现峰值。
②. 镀液pH对镀层硬度的影响
镀液pH对镀层硬度的影响见图11-4(温度30℃,电流密度14A/d㎡,CrCl3·6H2O 25g/L,Fe3+/Nj+浓度比1:5)。
由图11-4可见,镀层的硬度随pH的升高而减小。这是由于pH升高,镀层中铁和铬的含量降低,使镀层硬度下降。pH升高,阴极析氢量减少,使合金层中氢含量减少而降低镀层硬度。pH1.5时,镀层硬度最高,pH2~2.5时,镀层中铁和铬的含量下降迅速,硬度下降缓慢。pH过低,析氢严重,表面出现气道和针孔。pH过高,Cr3+易发生羟桥基聚合反应,镀层边缘出现黑色沉积物,质量变坏。故pH应控制在2.0为宜。
b. 阴极电流密度的影响
①. 阴极电流密度对镀层成分含量的影响
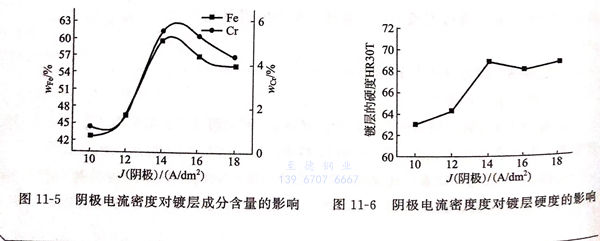
阴极电流密度对镀层成分含量的影响见图11-5(温度30℃,pH 2.0,CrCl3·6H2O 25g/L,Fe2+/Ni2+=1:5)。
由图11-5可见,随着阴极电流密度的增大,镀层中铁和铬的含量迅速增加,电流密度大于14A/d㎡后,镀层中铁和铬的含量略有下降。阴极电流密度过大。镀层表面质量变差,析氢严重,铁、铬含量略有下降。因此,电流密度控制在14A/d㎡为宜。
②. 阴极电流密度对镀层硬度的影响
阴极电流密度对镀层硬度的影响见图11-6(温度30℃,pH 2.0, CrCl3·6H2O 25g/L,Fe2+/Ni2+=浓度比1:5)。
由图11-6可见,随着阴极电流密度的增大,镀层中铁和铬的含量迅速增加,相应镀层的硬度也随之增加。
c. 温度的影响
①. 镀液的温度对镀层成分含量的影响
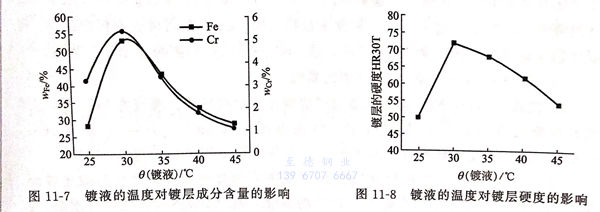
镀液的温度对镀层成分含量的影响见图11-7(电流密度14A/d㎡,pH=2, CrCl3·6H2O 25g/L,Fe2+/Ni2+浓度比1:5)。
由图11-7可见,镀液温度的升高,镀层中铁和铬的含量先增加后减小,在30℃时出现峰值。
②. 镀液温度对镀层硬度的影响
镀液的温度对镀层硬度的影响见图11-8 (电流密度14A/d㎡,pH=2, CrCl3·6H2O 25g/L,Fe2+/Ni2+浓度比1:5)。
由图11-8可见,随着镀液温度的升高,镀层的硬度在30℃时出现峰值。故温度应控制在30℃为宜。
d. 镀液中CrCl3·6H2O浓度的影响
①. 镀液中CrCl3·6H2O浓度对镀层成分含量的影响
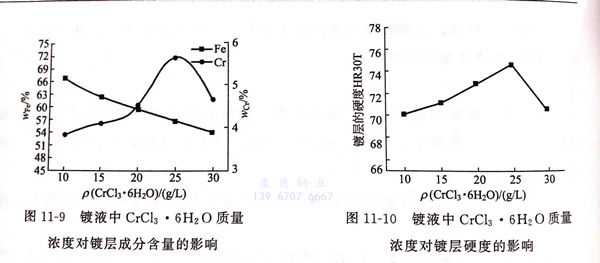
镀液中CrCl3·6H2O浓度对镀层成分含量的影响见图11-9,(电流密度14A/d㎡,pH=2,温度30℃,镀液中Fe2+/Ni2+浓度比1:5)。
由图11-9可见,随着镀液中CrCl3·6H2O浓度的增大,镀层铬的含量缓慢增加,铁含量缓慢减少,由于增大Cr3+浓度有利于Cr3+的沉积,但Cr3+浓度过大,Cr3+易发生羟桥反应,使Cr3+在阴极放电析出困难,使镀层中铬含量降低,故CrCl3·6H2O浓度应控制在25g/L为宜。
②. 镀液中CrCl3·6H2O浓度对镀层硬度的影响
镀液中CrCl3·6H2O浓度对镀层硬度的影响见图11-10,(电流密度14A/d㎡,pH=2,温度30℃,Fe2+/Ni2+浓度比1:5)。
由图11-10可见,由于增大镀液中Cr3+的浓度,有利于Cr的沉积,镀层的硬度变化和镀层中铬的含量上升趋势相同,当CrCl3·6H2O 为25g/L时,镀层硬度达到峰值。Cr3+浓度过大,Cr3+易发生羟桥反应,Cr3+在阴极放电析出困难,镀层中铬含量降低,导致镀层硬度变小,故CrCl3·6H2O 应控制在25g/L为宜。
e. 镀液中Fe2+/Ni2+浓度比值的影响
①. 镀液中Fe2+/Ni2+浓度比值对镀层成分含量的影响
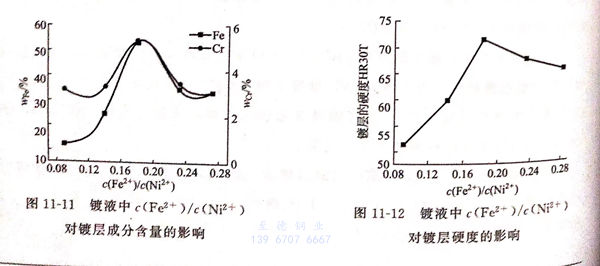
镀液中Fe2+/Ni2+浓度比对镀层成分的影响见图11-11(电流密度14A/d㎡2,pH=2,温度30℃,CrCl3·6H2O 25g/L)。
由图11-11可见,镀液中c(Fe2+)/c(Ni2+)对合金中铁的含量影响比较大,通过固定镀液中Ni2+的浓度而改变Fe2+的浓度,镀层中铁的含量先迅速增加,镍的含量自然下降,由于Fe-Ni-Cr合金为异常共沉积,镀液中Fe2+的浓度增加,更有利于优先沉积,铬含量也略有上升。当c(Fe2+)/c(Ni2+)接近0.2时,可得到合铁铬较高的合金镀层。
②. 镀液中Fe2+/Ni2+浓度对镀层硬度的影响
镀液中(Fe2+)/(Ni2+)浓度比对镀层硬度的影响见图11-12。
由图11-12可见,通过固定镀液中Ni2+的浓度而改变Fe2+的浓度,镀层中铁含量迅速增加,镍含量下降,更有利于先沉积,铬含量也略有上升。镀层的硬度则由于铁含量迅速上升而不断增大,当c(Fe2+)/c(Ni2+)接近0.2时出现最大值,随后铁和铬的含量下降,硬度也随之下降。由此可见,控制c(Fe2+)/c(Ni2+)接近0.2,可得到含铁、铬较高,硬度较大的合金镀层。
f. 镀层形貌和结构
按照表11-3的配方3 的最佳含量及工艺控制在最佳条件,电镀实验可得Cr6%、Fe 54%、Ni40%,硬度高达70(HR30T)的光亮镀层。所得镀层扫描电镜可见镀层表面结晶均匀,结构致密,没有孔洞和裂纹,镀层光亮性极好,只有当电沉积时间较长、镀层较厚时才会出现细小的裂纹,但也不存在针孔。



