1. 方法原理
在硫酸溶液中,六价铬被亚铁离子还原为三价铬:
2H2CrO4+6H2SO4+6FeSO4 = Cr2(SO4)3+3Fe2(SO4)3+8H2O
以苯基代邻氨基苯甲酸(PA酸)为指示剂指示反应终点。
三价铬在酸性溶液中,在硝酸银催化下,以过硫酸铵氧化成六价铭,得到总铬量。
Cr2(SO4)3+3(NH4)2S2O8+8H2O=-2H2CrO4+3(NH4)2SO4+6H2SO4
然后测定总铬量消耗的亚铁量减去六价铬消耗的亚铁量,即得三价铬量。
硝酸银对氧化反应起催化作用,银离子和过硫酸铵生成过硫酸银,过硫酸银能将三价铬氧化成六价铬。氧化反应完成后,硝酸银仍恢复原来的状态。过量的过硫酸铵对测定有干扰作用,必须经煮沸后完全分解出氧气。分解反应如下:
2(NH4)2S2O8+2H2O = 2(NH4)2SO4+2H2SO4+O2↑
2. 试剂
①. 硫酸
1+1,即1体积分量的硫酸加入1体积分量的水中。
②. 苯基代邻氨基苯甲酸(PA酸)指示剂
0.27g PA酸溶于5mL的5%碳酸钠溶液中,以水稀释至250mL.
③. 标准0.1mol硫酸亚铁铵溶液
配制:称取分析纯硫酸亚铁铵40g[FeSO4·(NH4)SO4·6H2O]溶于冷的5+95硫酸(5体积分量的硫酸溶于95体积分量的水中)500mL中,溶解完毕后以5+95硫酸稀释至1L.亚铁溶液在空气中易氧化,应加入纯铝片若干,以还原被氧化的高铁。应于使用前定期标定。铝片的存在,有效维持亚铁离子浓度的稳定(1个月左右)。同时投入少量NaHCO3,产生的CO2气体隔绝空气的氧化。
标定:以重铬酸钾标定。用移液管吸取标准0.1mol重铬酸钾溶液(配制:取分析纯重铬酸钾于150℃干燥1h,在干燥器内冷却,准确称取29.421g,溶解于水,在量瓶中稀释至1L.不需标定)10mL于250mL锥形瓶中,加水70mL及1+1 硫酸10mL,磷酸1mL.加入PA酸指示剂4滴,溶液呈紫红色,用配制好的0.1mol 硫酸亚铁铵溶液滴定至紫红色转绿色为终点,记录耗用的硫酸亚铁铵的体积V(mL)。(终点前应逐滴观察。)
计算:标准硫酸亚铁铵溶液的摩尔浓度
M= 10×0.1×6 / V(mol/L)
④. 1%硝酸银溶液。称取1g重的硝酸银溶解于100mL水中。或用0.1mol/L硝酸银标准溶液。
⑤. 过硫酸铵。固体。
3. 分析方法
①. 吸取电解液各5mL于A、B两个250mL锥形瓶中,各加水50mL(A、B各用于测定铬酐和三价铬之用)。
②. 各加1+1硫酸10mL.
③. 于B瓶中加硝酸银10mL.
④. 于B瓶中加过硫酸铵2g,煮沸至冒大气泡2min左右,冷却。
⑤. 向A、B两瓶中加PA酸5滴,摇匀。
⑥. 用标准0.1mol硫酸亚铁铵溶液滴定A、B两瓶各至由紫红色变绿色为终点,记录分析A、B各耗用标准硫酸亚铁铵溶液各为V1和V2的体积(mL)。V1为分析铬酐时耗用硫酸亚铁铵溶液的体积(mL),V2为分析总铬酐时耗用硫酸亚铁铵溶液的体积(mL).
4. 计算
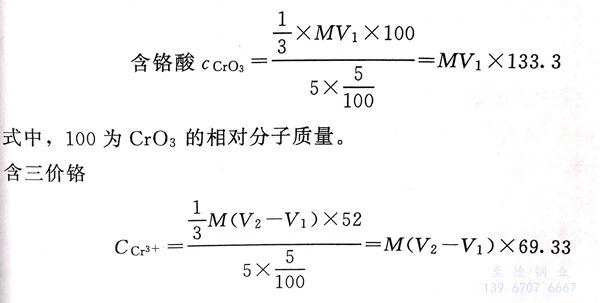
式中,52为Cr的相对原子质量。
注:如果铬酐或三价铬含量过高,可适当减少电解液所取体积。



