从矿石或化合物中提炼金属,是还原过程;而腐蚀则是将金属氧化为矿石或化合物,是冶炼的逆过程,即氧化过程。这两个过程的原理是可以相互借用的。干腐蚀为高温氧化,湿腐蚀是电解液腐蚀。在液态或固态电解质中的金属腐蚀过程是电化学过程,是一种涉及电子转移的化学过程。因此,腐蚀能否进行,取决于金属能否离子化;而金属离子化的趋势,可以用金属的标准电极电位(ε)来表示。定性地讲,金属的标准电位越负,则越易离子化。
如,钢表面生锈是电化学腐蚀的结果。钢暴露在大气中,表面吸附了一层很薄的水膜,钢表面不同的电极电位和水膜构成了微电池,就会引起电化学腐蚀。
钢本身由于包含有碳化物、夹渣物等,各部分的组织和成分是不均匀的,此外内部应力也不均匀,这些都促使各部分在电解质溶液中,产生相互间的电极电位差。这种电极电位差愈大,微阳极和微阴极间的电流强度愈大,钢的腐蚀速度也愈大,结果是微阳极部分发生严重的腐蚀。
这种腐蚀微电池所引起电化学腐蚀,在开始阶段和腐蚀过程中,就会产生阳极极化作用和阴极极化作用。
一、极化作用
在电化学腐蚀中,能够控制腐蚀反应速度的现象称为极化,极化可使阳极与阴极参与反应的速度得到减弱和减缓。
极化作用的原理 当电流通过原来电池开始流动的瞬间,在电极上产生化学变化,这些变化试图建立一个新的与原来电池电压方向相反的伏打电池。这种新的反电压称为极化,其方向与原来电池的电压方向相反,从而使原来的电池电压得到了削弱。也就是说,由于极化使得腐蚀电池中金属的各电位彼此相互接近 阳极电位的下降
称为阳极极化,阴极电位的下降称为阴极极化。电池电压的下降、减小使得流过电池的电流也减小。阳极、阴极的极化并不总是同时以同种程度发生,有些情况下,阳极发生较大的极化,而有些情况下则是阴极发生较大的极化。在前一种情况下,反应由阳极控制;后一种情况下,反应由阴极来控制(图1-1a和图1-1c)。为了提高金属材料的耐腐蚀性,可以通过提高其极化性能来实现;作为能源的电池,则是通过降低其极化性能来实现的。

1. 铁 - 水体系的极化
在铁-水体系中,反应是受阴极控制的,因为氢离子数量少,也就是说,阴极极化限制着反应速度;而氧气是一种去极化剂,因为它增加了这个反应中的腐蚀电流及一定的腐蚀量。有一点应该考虑到,这就是:极化可限制腐蚀速度,使之不能达到最大值,如果不存在极化,腐蚀速度将可能达到最大值。电解液中离子的缓慢移动、原子缓慢地结合成气体分子或电解液中离子的缓慢溶解,都可能是极化的表现形式。
2. 影响极化的因素
同其他的所有性能一样,极化性能不仅因电极材料而异,而且与电解质有密切关系,因此,极化的程度是不同的。一些腐蚀反应由于高自发性与低极化性,使得腐蚀反应进行得很快;而另一些腐蚀反应,尽管它们有着明显的腐蚀趋势,但由于高极化性则使得腐蚀反应进行得非常慢。这就是研究、利用极化的目的所在。影响极化的因素包括:
a. 增加反应面积,使腐蚀更容易发生,由此而降低了极化率。
b. 搅拌或电解液流动带走了表面的腐蚀产物,从而提供了大量与电极接触的离子,增加了腐蚀速度而降低了极化;另一方面,如果阴极反应起控制作用,则搅拌对腐蚀速度没有影响。
c. 氧气可有效地使电极去极化或通过带走反应产物原子态的氢使反应更快地进行。
d. 温度增加,可使大多数反应速度增加,因此降低了极化率。
3. 极化图
极化现象通常用极化曲线图本示 ,见图1-1。极化图就是阳极电位和阴极电位与其电流的关系图。这些曲线也称为Evans曲线,这是以腐蚀科学的创始人之一 Ulick Evans命名的。图1-1a表示由阴极控制腐蚀电池的极化图。图1-1b为钝化状态由金属阳极控制腐蚀电池的极化曲线图,从图1-1b可以看出,极化曲线并不是想象的那样是沿直线极化的,而是沿着“S”形曲线极化的。活化状态-钝化状态转变的电化学行为,可由这些曲线加以说明。图1-1c是由阳极控制腐蚀电池的极化图,此图可以说明氢气对阴极极化的作用及聚集的金属离子和腐蚀产物对阳极极化的作用。实际上,极化曲线并不是直线,极化曲线的形状取决于极化的具体过程。
4. 极化测定
耦合件极化的测定可以提供关于极化行为的精确信息,特别是对局部腐蚀的预测。用极化技术与临界电位可以衡量金属与合金在氯化物溶液中,点腐蚀与缝隙腐蚀的敏感性。
5. 钝化
有时材料发生腐蚀时,会产生有黏附性的腐蚀产物,这种黏附性的腐蚀产物能够起到保护材料免受进一步腐蚀作用,这也就是钝化作用。这些被钝化的材料在特定的环境中腐蚀非常小,而在其他环境中却有可能产生相当严重的腐蚀。例如,从电动序来看,铝的腐蚀速度应该是较高的,然而实际上,铝在除卤化物外的多数介质里具有较强的耐腐蚀能力。这种现象称为钝化。镍、钛、锆、铬和不锈钢等材料都是因为可自钝化而具备了耐腐蚀的能力。
通过研究极化曲线,也就是Evans曲线,可以帮助更好地理解合金的钝化。图1-1b中显示的钝化合金的阳极极化曲线明显不同于没有钝化的合金,图1-1d是钝化与没有钝化材料的极化曲线比较图。钝化明显的是阳极极化的结果。在金属与环境之间,由金属氧化物或化学反应吸收的氧气形成一层牢固的保护薄膜,可以防止金属与电解液进一步接触电解。在金属为铁的情况下,当有更多的氧可以到达阴极的金属表面进行反应时,就可以形成一层保护性的钝化膜,金属表面因此达到钝化状态,对避免加速腐蚀起到了非常重要的作用。在特定的情况下,特定的合金能否钝化取决于阳极和阴极极化效果。
钝化状态合金被广泛用做热交换器结构的耐腐蚀材料,钝化状态金属的耐腐蚀性取决于铬含量、环境中的氯化物和氧含量以及温度。在特定的条件下达到钝化状态,取决于各种钝化因素的相对值能否超过其阻碍钝化的因素。例如,高的铬含量有利于钝化,低的温度有利于钝化,含有去钝化离子的氯化物阻碍钝化,而氧有利于钝化。
6. 钝化状态合金的行为
尽管钝化状态材料在特定的环境下,钝化状态材料腐蚀非常小,但在其他情况下可能腐蚀相当严重。相反,通常显示钝化状态的合金在非钝化状态下,常常是非常活泼的。某些元素可以击穿钝化膜,造成钝化膜不连续处的金属被腐蚀。例如,氯离子破坏铝、铁以及不锈钢的钝化,造成点腐蚀。因此,使用钝化状态金属的用户应特别注意点腐蚀、应力腐蚀开裂、敏化以及贫氧腐蚀等。
对于金属的耐腐蚀性,希望有较高的极化性能;对于作为能源的电池或金属的表面处理,却要求有较低的极化性能。同其他的所有性能一样,极化性能不仅因电极材料而异,也与电解质密切相关。
二、不锈钢的极化曲线
不锈钢的极化曲线,见图1-2。图1-2描述了不锈钢以及有活化、钝化转变的合金电极动力学过程,并按电位分为活化区(A)、钝化区(P)和过钝化区(T)。应用阳极极化曲线(εm)及相关的阴极极化曲线(图1-2中的①、②、③、④),可以求得腐蚀电位和腐蚀电流密度(图1-2中的阳极化曲线和阴极化曲线的交点A、B、C、D、E、F)。
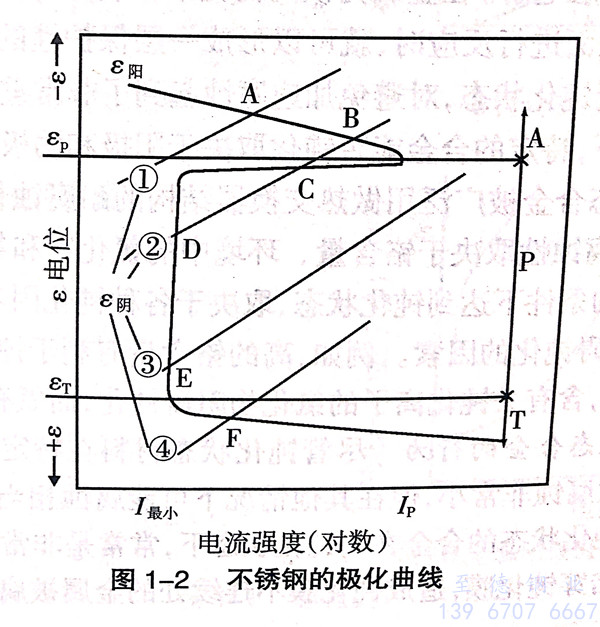
金属或合金在不同条件下,其电化学腐蚀有四种状态:一是活化状态,腐蚀电流强度较大,因而腐蚀速度较快;二是相对稳定状态,即金属处于可以钝化也可以活化状态;三是钝化稳定状态,金属只处于钝化状态,而且是稳定的,能够自动钝化,只有很小的腐蚀电流,腐蚀速度很小;四是过钝化状态,当金属处于过钝化状态时有较高的腐蚀电流。
为了提高不锈钢的耐腐蚀性能,我们希望:
a. 不锈钢易处于钝化态,也就是可以自动钝化;
b. 不锈钢钝化后腐蚀电流密度要很低;
c. 不锈钢钝化状态的(腐蚀)电位范围要宽。
上述三点分别指出了不锈钢获得钝化的必要条件、钝化状态的腐蚀速度和钝化状态的相对稳定性。
不锈钢只有处在钝化状态方能耐腐蚀,这时钝化状态腐蚀电流最小,腐蚀速度最慢,其他三种状态下不锈钢都是不耐腐蚀的。由此可见,不锈钢的“不锈”是相对的,只是腐蚀速度比较慢就是了。



