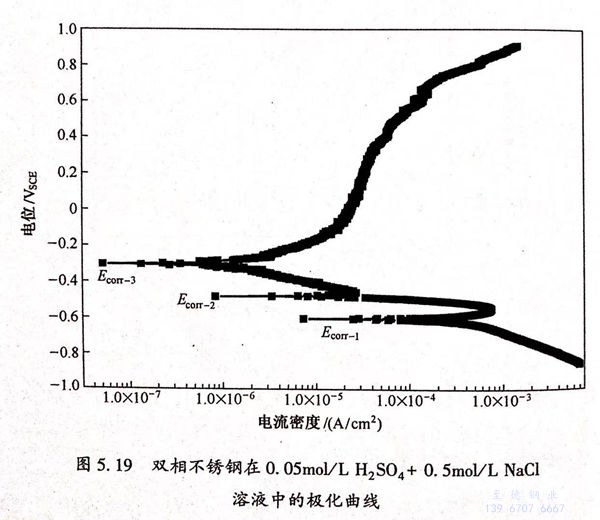
图5.19是双相不锈钢在0.05mol/L H2SO4+0.5mol/L NaCl溶液中的极化曲线。从图5.19中可以看出,极化曲线存在三个自腐蚀电位Ecorr-1、Ecorr-2和Ecorr-3,这三个电位分别处于金属的活性溶解区,溶解-钝化过渡区和金属的钝化区,表明体系是一个非稳定体系。三个自腐蚀电位分别为-0.61VSCE、-0.49VSCE和-0.31VSCE。
溶液中的阴极反应为H+的还原反应(HER),阳极反应为金属的溶解反应。根据混合电位理论,H+的还原反应电流密度iH+,和金属溶解反应的电流密度idiss相等时就会形成一个稳定的自腐蚀电位。也即阴、阳极反应的净电流密度inet(极化曲线中测量的腐蚀电流密度)是阴、阳极反应的电流密度的代数和为
inet = iH++idiss
在电位低于Ecorr-1,时,HER的电流密度大于金属溶解反应的电流密度,在二者代数和为零时就形成了稳定的腐蚀电位Ecorr-1。在Ecorr-1和Ecorr-2之间,金属溶解反应的电流密度大于HER的电流密度,因此极化曲线上的测量电流即为阳极电流。当电位高于Ecorr-2时,电流密度逐渐降低,并且测量电流密度从阳极电流变为阴极电流,这是由于在金属钝化表面上HER反应的电流密度大于钝化膜的溶解反应的电流密度。当电位到达Ecorr-3时,阴、阳极电流密度相等;当电位高于Ecorr-3时,电流为阳极电流。
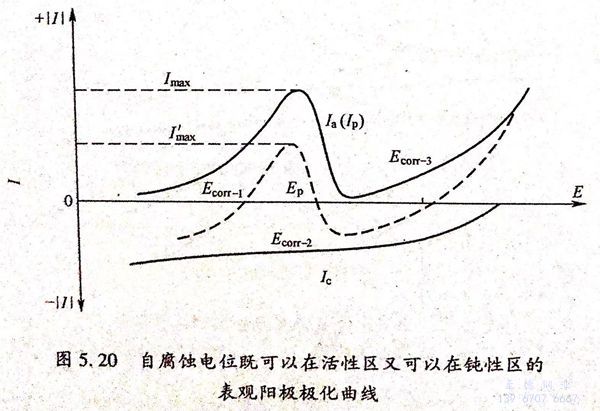
图5.20阐述了为什么会出现三个自腐蚀电位,以及在什么情况下才能出现三个自腐蚀电位。图5.20中Imax是金属的最大阳极溶解电流密度,I'max为测量的最大电流密度,Ia和Ic分别为阳极和阴极电流密度,IP为金属钝化时的电流密度。Ecorr-1、Ecorr-2和Ecorr-3为自腐蚀电位。当金属的平衡电位E..(因为它是平衡电位,故不能在图上标注出来)>Ep,且在钝性电位区间IC≥IP ,但在E=Ep时(Ic)EP<Imax 时测量的极化曲线如图5.20中的虚线所示。在这种情况下,存在着三个电位值、使得金属的阳极溶解电流密度的值等于阴极去极化剂阴极还原反应电流密度的绝对值。具有这一类型的阳极极化曲线的腐蚀体系的一个重要性质:虽然金属表面不能自动从活性溶解状态转变为钝态,但如果利用外加电流使金属阳极极化到钝性区间,就可以依靠去极化剂的阴极还原反应来维持金属电极的电位为Ecorr-2.也即就是说Ecorr-2是一个非稳定电位,可以转变为Ecorr-1或Ecorr-3.
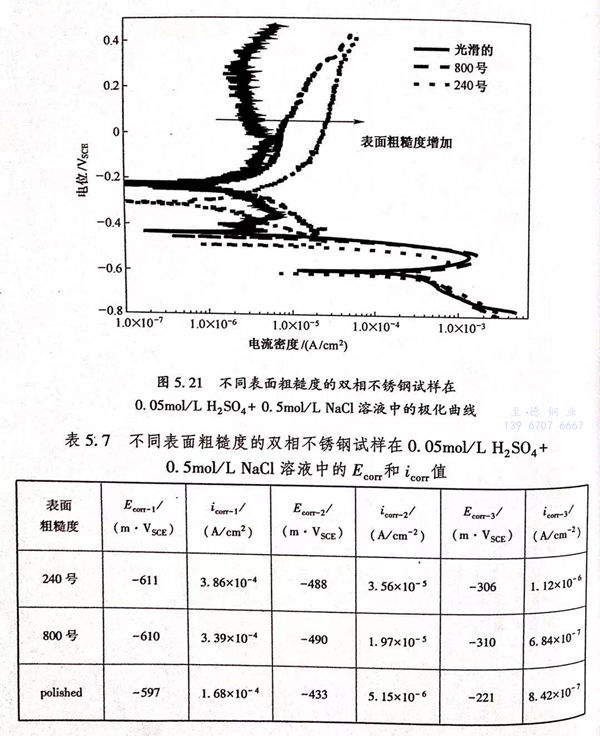
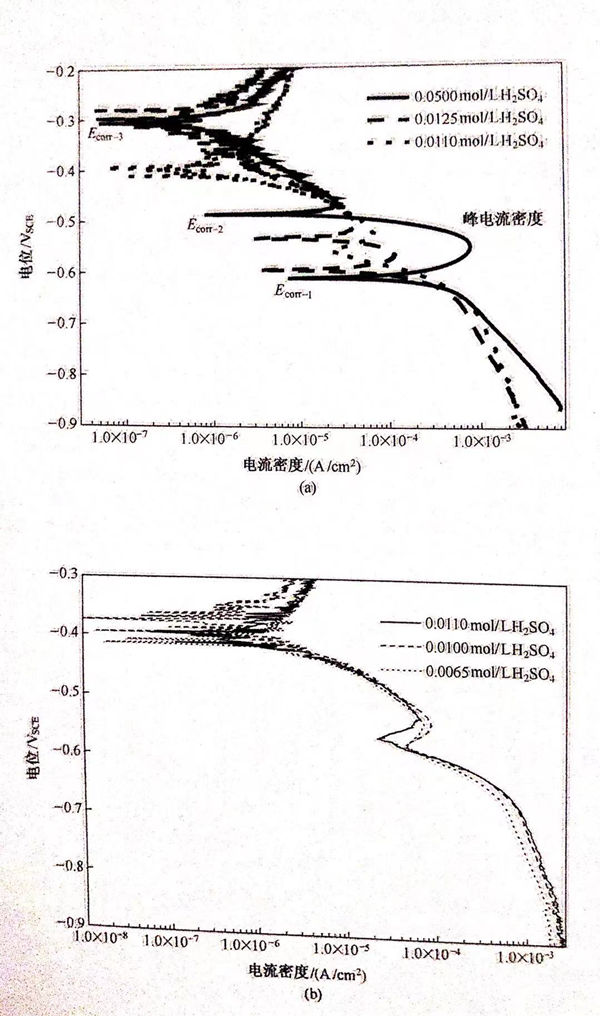
为了研究阳极过程的变化对双相不锈钢的腐蚀过程的影响,测量了不同表面粗糙度的试样在0.05mol/L H2SO4+0.5mol/L NaCl溶液中的极化曲线,如图5.21所示,从极化曲线中拟合出的自腐蚀电位和腐蚀电流密度的值列于表5.7中。从图5.21中可以看出,在三种不同粗糙度下得到的曲线都出现了三个自腐蚀电位,并且电流密度随着表面粗糙度的增加而增加。在钝化区(电位高于Ecorr-3)电流密度的增加尤为明显,这可能是由于表面粗糙度越大试样暴露在溶液中的真实面积越大造成的。
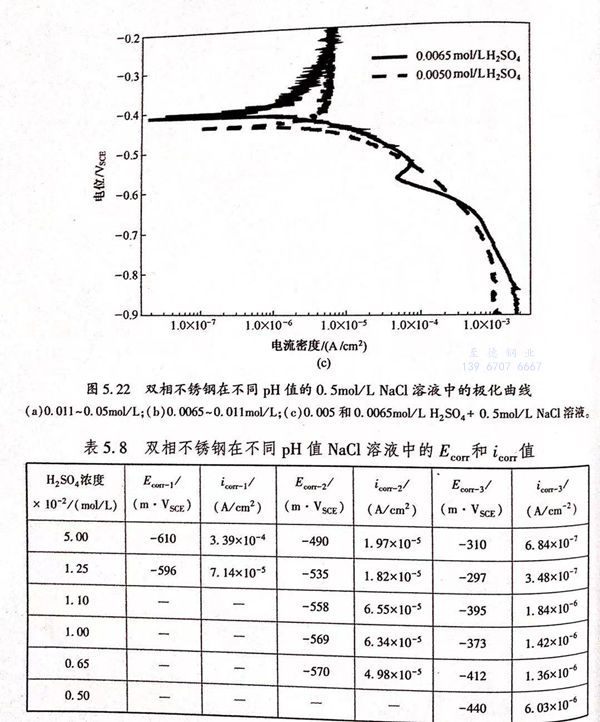
通过改变溶液的硫酸浓度来研究pH值的变化对双相不锈钢在H2SO4+0.5mol/L NaCl中的腐蚀行为的影响。图5.22是不同硫酸浓度条件下双相不锈钢在H2SO4+0.5mol/L NaCl溶液中的极化曲线,从极化曲线中拟合的自腐蚀电位和腐蚀电流密度的值列于表5.8中。从图5.8中可以看出,pH值对双相不锈钢在NaCI溶液中的腐蚀行为有显著影响,并且可以改变自腐蚀电位的个数,当硫酸浓度大于0.011mol/L时出现三个自腐蚀电位,如图5.22(a)所示;当硫酸浓度介于0.0065~0.011mol/L之间时出现两个自腐蚀电位,如图5.22b)所示;当硫酸浓度降低到0.005mol/L时只有一个自腐蚀电位,如图5.22c)所示。
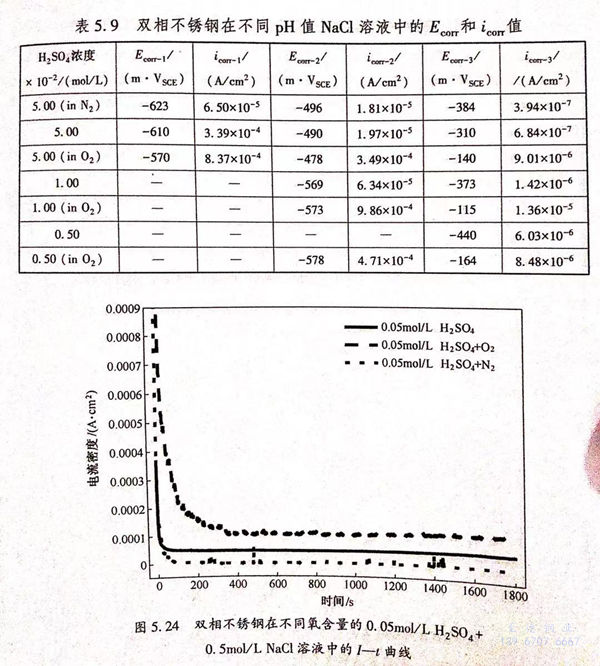
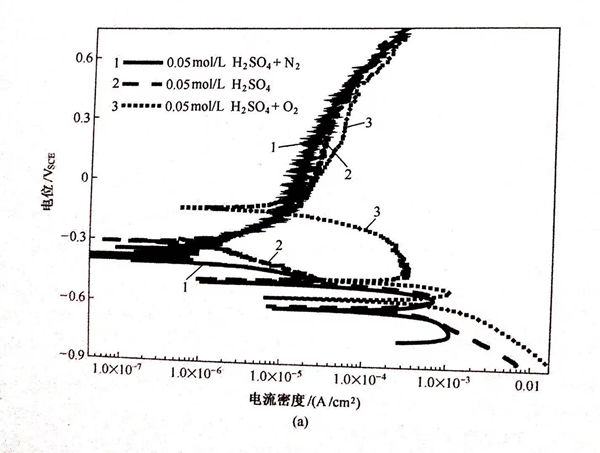
为了研究溶液中的溶解氧对双相不锈钢在H2SO4+0.5mol/L NaCl 溶液中的腐蚀行为的影响,分别选取双相不锈钢在出现三个、两个和一个自腐蚀电位的特殊情况下的三种溶液成分,研究了溶液的氧浓度对双相不锈钢的腐蚀行为的影响。图5.23为所测量的极化曲线,从图中可以看到在氧饱和的0.05mol/L H2SO4+0.5mol/L NaCl溶液和0.011mol/L H2SO4+0.5mol/L NaCl溶液中(图5.23(a)、(b)),氧浓度的变化不能改变自腐蚀电位的个数,但是在0.005mol/L H2SO4+0.5mol/L NaCl溶液中(图5.22(c))却可以使自腐蚀电位的个数从1个增加到2个。表5.9中所列的自腐蚀电位和腐蚀电流密度的值是通过图5.23拟合后得到的。在氧饱和的溶液中测得的Ecorr-3值均高于在空气饱和的溶液中的测量值,且腐蚀电流密度icorr-3也显著增加。将待测溶液用氮气饱和,以消除溶液中的溶解氧对阴极过程的影响,发现与除氧前的结果相比,除氧后测得的极化曲线的自腐蚀电位和腐蚀电流密度都有所降低。这表明溶液中的溶解氧参与了金属的电极反应过程,溶液中的阴极反应是氧的还原反应和氢还原反应的叠加。

为了研究溶液中的氧含量对电极过程的影响,测量了双相不锈钢在不同氧含量的溶液中的再钝化能力曲线。图5.24是双相不锈钢在不同氧含量(氧饱和、空气饱和与氮气饱和)的0.05mol/L H2SO4+0.5mol/L NaCl溶液中外加电位为0.3V时的再钝化曲线。从图5.24中可以看出,在最初的很短时间内,SCE电流密度迅速降低,然后随着时间的增加,电流达到一个稳定的值iss.电流迅速下降是由于钝化膜的生成速度大于膜的溶解速度,在极短时间内形成了具有良好保护性能的钝化膜,阻止了金属的溶解;当钝化膜的生成速度和溶解速度达到平衡时电流密度趋于一个稳定的值。iss的值随溶液中的氧含量增加而增加,这表明了溶液中的溶解氧可以影响双相不锈钢的钝化过程,从而影响腐蚀反应的阴、阳极过程。